化学综合是湖南师范大学化学类博士研究生招生考试的核心专业科目,其真题对把握化学命题方向、提升化学问题分析与实验设计能力具有关键指导意义。考生可通过以下权威渠道获取该校全学科考博真题(含英语、化学综合、专业课等)及配套高分答案详解,为备考提供精准资源支撑:
- 考博信息网官网:http://www.kaoboinfo.com/
- 湖南师范大学历年考博真题下载专用页面:http://www.kaoboinfo.com/shijuan/school/408061_1_1202431.html
湖南师范大学 2551 化学综合考博真题覆盖 2012-2025 年关键年份,所有年份真题均配备完整、精准的高分答案详解,解析由化学专业教研团队编写,涵盖考点定位、化学现象分析、理论逻辑推导及实验设计梳理,能帮助考生高效掌握命题规律与应试策略。以下为 2022 年湖南师范大学 2551 化学综合考博真题(精选 6 道典型题目)及答案详解,助力考生针对性备考。
-
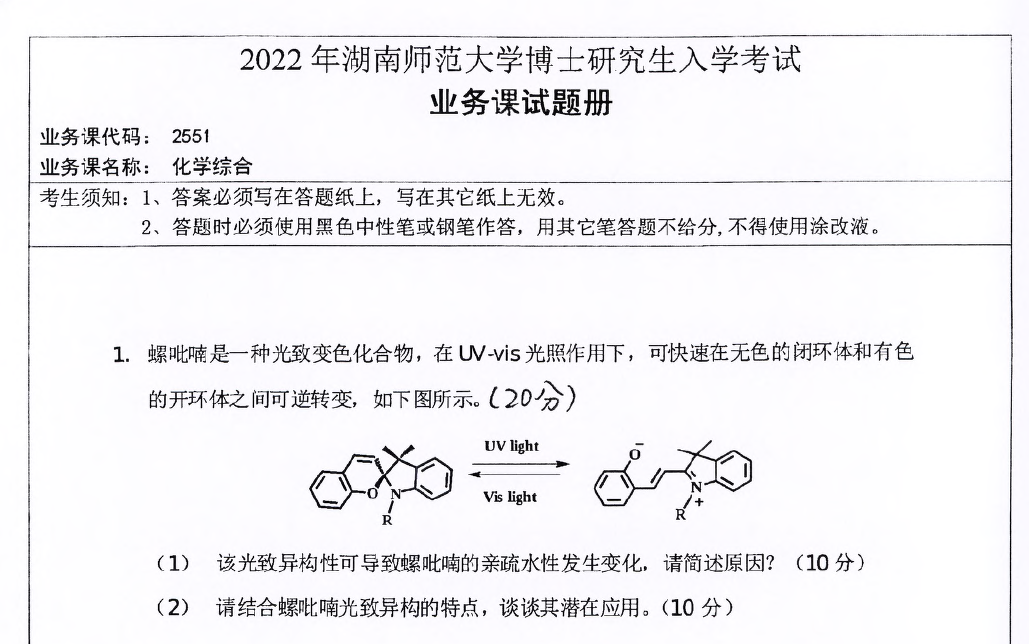
螺吡喃是一种光致变色化合物,在 UV-vis 光照作用下,可快速在无色的闭环体和有色的开环体之间可逆转变。
(1)该光致异构性可导致螺吡喃的亲疏水性发生变化,请简述原因?
(2)请结合螺吡喃光致异构的特点,谈谈其潜在应用。
-
论化学平衡移动原理的核心内涵与实验验证方法
-
分析配合物的价键理论与晶体场理论的差异与应用
-
简论有机合成中官能团保护的策略与实例
-
试论纳米材料的表面效应与催化性能的关系
-
分析酸碱质子理论的发展与应用范围
本题考查有机化学中 “光致变色化合物” 的性质与应用,聚焦螺吡喃的结构变化对性质的影响及实际应用,是化学综合学科中功能材料化学研究的重点考点。
-
亲疏水性变化的原因
螺吡喃的闭环体中,分子结构较为紧凑,含有较多的疏水基团(如芳香环、烷基等),整体表现为疏水性;而在 UV 光照射下转变为开环体后,分子结构中形成了带电荷的部分(如氧负离子和氮正离子),这些带电基团具有较强的亲水性,使得开环体的亲水性显著增强。因此,通过光照控制螺吡喃的结构变化,可实现其亲疏水性的可逆调控。
-
潜在应用
- 光控药物释放:利用螺吡喃的光致亲疏水性变化,将药物包裹在由螺吡喃基元组成的纳米载体中。在体外或体内特定部位施加 UV 光,使螺吡喃从疏水性闭环体转变为亲水性开环体,纳米载体解体,实现药物的定点、定时释放,提高药物疗效并减少副作用。
- 光控传感器:基于螺吡喃光致变色的特性,可设计成化学传感器。例如,当环境中存在特定的离子或分子时,螺吡喃的光致变色行为会发生改变(如变色速率、颜色深度等),通过检测这些变化,可实现对目标物质的定性或定量分析。
- 光控智能材料:将螺吡喃引入高分子材料中,制备光控智能材料。如光控润湿性材料,通过光照控制材料表面的亲疏水性,实现对液体在材料表面的浸润性的调控,可应用于微流控芯片、自清洁材料等领域。
- 光信息存储:利用螺吡喃的光致变色的可逆性和稳定性,可作为信息存储的介质。通过不同的光照条件记录信息(如闭环体为 “0”,开环体为 “1”),实现高密度的光信息存储,具有存储容量大、读取速度快等优点。
光致变色化合物是功能材料领域的研究热点,除螺吡喃外,偶氮苯、二芳基乙烯等也是常见的光致变色体系。螺吡喃的光致变色性能在分子开关、智能器件等领域具有广阔的应用前景。当前,科研人员正致力于开发具有更高光响应效率、更好稳定性和多功能集成的螺吡喃基材料,以满足实际应用的需求。
本题考查化学热力学中 “化学平衡移动” 的理论,聚焦其内涵与实验验证,是化学综合学科中化学平衡研究的基础考点。
-
核心内涵
化学平衡移动原理(勒夏特列原理)指出:如果改变影响平衡的一个条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动。
- 浓度:增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;反之,平衡向逆反应方向移动。
- 压强:对于有气体参与的反应,增大压强(减小体积),平衡向气体分子数减少的方向移动;减小压强(增大体积),平衡向气体分子数增多的方向移动。若反应前后气体分子数不变,压强变化不影响平衡。
- 温度:升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
-
实验验证方法
- 浓度对平衡的影响:以 Fe³⁺与 SCN⁻的配位反应(Fe³⁺ + 3SCN⁻ ⇌ Fe (SCN)₃)为例,在平衡体系中加入 FeCl₃溶液(增大 Fe³⁺浓度),溶液红色加深,说明平衡向正反应方向移动;加入 KSCN 溶液(增大 SCN⁻浓度),同样红色加深;加入 NaOH 溶液(与 Fe³⁺反应,减小 Fe³⁺浓度),红色变浅,说明平衡向逆反应方向移动。
- 压强对平衡的影响:以 N₂O₄ ⇌ 2NO₂为例,将一定量的 N₂O₄气体充入注射器中,压缩注射器(增大压强),气体颜色先变深(NO₂浓度瞬间增大),后变浅(平衡向生成 N₂O₄的方向移动,NO₂浓度减小);拉伸注射器(减小压强),气体颜色先变浅,后变深(平衡向生成 NO₂的方向移动)。
- 温度对平衡的影响:以 2NO₂ ⇌ N₂O₄(ΔH < 0)为例,将装有 NO₂和 N₂O₄混合气体的烧瓶分别放入热水和冷水中,放入热水中(升高温度),气体颜色变深(平衡向逆反应方向移动,NO₂浓度增大);放入冷水中(降低温度),气体颜色变浅(平衡向正反应方向移动,NO₂浓度减小)。
化学平衡移动原理是化学热力学的重要理论,它不仅适用于化学平衡,也可推广到物理平衡(如溶解平衡、电离平衡等)。该原理在工业生产中具有重要的指导意义,如合成氨工业中,通过增大压强、适当提高温度(考虑催化剂活性)等条件,使平衡向生成氨的方向移动,提高氨的产率。
考博备考需依托权威真题资源,湖南师范大学 2551 化学综合考博真题及全学科考博资料(含英语、专业课)均配备高分答案详解,可通过以下渠道获取:
- 考博信息网官网:http://www.kaoboinfo.com/
- 湖南师范大学历年考博真题下载专用页面:http://www.kaoboinfo.com/shijuan/school/408061_1_1202431.html
建议考生结合真题及答案详解系统备考,重点掌握 “化学经典理论解读”“化学实验与现象分析”“学术观点辨析” 三大能力,同时关注化学前沿研究(如绿色化学、新能源材料等),提升学术表达与问题解决能力,预祝各位考生考博成功!

